Егэ по химии алканы. Алканы — номенклатура, получение, химические свойства. Дегидрирование и циклизация
Органическая химия — это химия углерода, валентность которого равна 4. Т.е., каждый атом углерода образует 4 связи (сигма-связи). Это может быть связь — С — С — , это может быть связь -С-H. Одинарная связь считается насыщенной , т.е. достигается максимальное перекрывание электронной плотности между атомами.
Предельные углеводороды — класс алканы (углеводороды с насыщенными связями)
Сигма-связь (σ-)
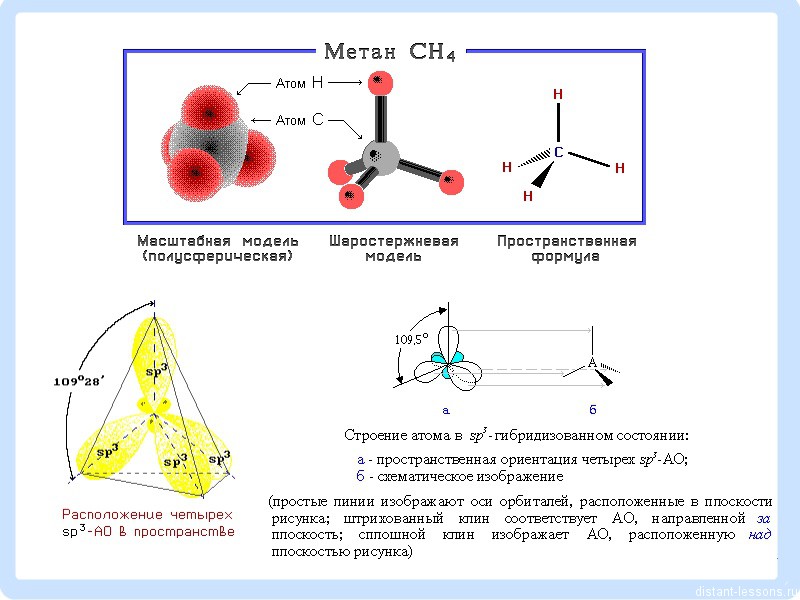
Атомы углерода находятся в состоянии Sp³-гибридизации:
Т.е. вещества класса Алканы (парафины — старое название) - алифатические (нециклические) предельные углеводороды, в которых атомы углерода связаны между собой простыми (одинарными, насыщенными) связями в неразветвленные или разветвленные цепи. Угол между связями С-C составляет 109°28′, поэтому молекулы нормальных алканов с большим числом атомов углерода имеют зигзагообразное строение (зигзаг)
Общая формула алканов: С n H 2n+2 , где n = числу атомов углерода.
Номенклатура веществ класса алканов строится из двух частей.
Первая часть «говорит» о количестве атомов углерода, вторая — о связи -С-С-. У алканов вторая часть — всегда -ан , а первую часть надо выучить:
Физические свойства алканов:
C1-C4 — газообразные вещества;
С5- С17 — жидкости;
С18-… — твердые вещества.
Химические свойства
Алканы — довольно химически устойчивы. Между атомами насыщенная связь, поэтому вещества класса алканы очень слабо активны.
Максимум на что они способны это:
Реакции замещения: реакция идет на свету по радикальному механизму:
С2H6 + Cl2 = C2H5Cl + HCl, такое замещение может идти до полного замещения атомами хлора атомов водорода: С2Сl6.
Реакция Вюрца — «именная» реакция удлиннения цепи:
C2H5Cl + 2Na +ClC2H5 → C4H10 + 2NaCl (из этана получили бутан)
Реакция Коновалова: c разбавленной азотной кислотой под давлением
С2H6 + HNO3 (HO-NO2) → С2H5NO2 + H2O
Реакции разложения (крекинг):
длинные вещества класса алканы разлагается на алкан (более короткий) и алкен:
CH 3 -CH 2 -CH 3 (пропан) - 400°C > CH 4 (метан)+ CH 2 =CH 2 (этилен)
Окисление алканов (горение): как и все органические вещества, алканы горят до образования углекислого газа и воды:
2C2H6 + 7O2 = 4CO2 + 6H2O
Получение веществ класса алканы:
Из неорганических веществ:
гидролиз карбида алюминия:
Al4C3 + 12H2O = 4Al(OH)3 +3CH4 (метан)
C+2H2 = CH4 (при высоком давлении и температуре)
Гидрирование алкенов:
С2H4 + H2 = C2H6 (этан)
Еще одна «именная» реакция:
реакция Кольбе: электролиз солей карбоновых кислот :
2СH3COONa -(электролиз)-→ СH3-CH3 (этан) + 2СO2 +2Na
Реакция солей карбоновых кислот с аналогичными щелочами:
C2H 5 COONa + NaOH -- t° > C2H6 + Na 2 CO 3
Тест "Алканы"
1. У пропана и 3,3-диметилгексана общая формула:
CnH2n
СnH2n+2
СnH2n-2
СnH2n-4
2. Не имеет изомеров:
пентан
бутан
гексан
пропан
3. Выберите свойства алканов:
окисляются, реагируют с водой, обесцвечивают бромную воду
реагируют с галогенами, с галогеноводородами и с кислотами - окислителями
реагируют с хлором на свету, с азотной кислотой под давлением, крекинг
легко вступают в реакции замещения
4. При горении алканов образуются:
CO2 и H2O
алканы с меньшим количеством атомов углерода
Характерные химические свойства углеводородов: алканов, алкенов, диенов, алкинов, ароматических углеводородов
Алканы
Алканы — углеводороды, в молекулах которых атомы связаны одинарными связями и которые соответствуют общей формуле $С_{n}Н_{2n+2}$.
Гомологический ряд метана
Как вы уже знаете, гомологи — это вещества, сходные по строению и свойствам и отличающиеся на одну или более групп $СН_2$.
Предельные углеводороды составляют гомологический ряд метана.
Изомерия и номенклатура
Для алканов характерна так называемая структурная изомерия. Структурные изомеры отличаются друг от друга строением углеродного скелета. Как вам уже известно, простейший алкан, для которого характерны структурные изомеры, — это бутан:
Рассмотрим подробнее для алканов основы номенклатуры ИЮПАК:
1. Выбор главной цепи.
Формирование названия углеводорода начинается с определения главной цепи — самой длинной цепочки атомов углерода в молекуле, которая является как бы ее основой.
2.
Атомам главной цепи присваивают номера. Нумерация атомов главной цепи начинается с того конца, к которому ближе стоит заместитель (структуры А, Б). Если заместители находятся на равном удалении от конца цепи, то нумерация начинается от того конца, при котором их больше (структура В). Если различные заместители находятся на равном удалении от концов цепи, то нумерация начинается с того конца, к которому ближе старший (структура Г). Старшинство углеводородных заместителей определяется по тому, в каком порядке следует в алфавите буква, с которой начинается их название: метил (—$СН_3$), затем пропил ($—СН_2—СН_2—СН_3$), этил ($—СН_2—СН_3$) и т. д.
Обратите внимание на то, что название заместителя формируется заменой суффикса -ан на суффикс -ил в названии соответствующего алкана.
3. Формирование названия.
В начале названия указывают цифры — номера атомов углерода, при которых находятся заместители. Если при данном атоме находятся несколько заместителей, то соответствующий номер в названии повторяется дважды через запятую ($2.2-$). После номера через дефис указывают количество заместителей (ди — два, три — три, тетра — четыре, пента — пять) и название заместителя (метил, этил, пропил ). Затем без пробелов и дефисов — название главной цепи. Главная цепь называется как углеводород — член гомологического ряда метана (метан, этан, пропан и т. д. ).

Названия веществ, структурные формулы которых приведены выше, следующие:
— структура А: $2$-метилпропан;
— структура Б: $3$-этилгексан;
— структура В: $2,2,4$-триметилпентан;
— структура Г: $2$-метил $4$-этилгексан.
Физические и химические свойства алканов
Физические свойства. Первые четыре представителя гомологического ряда метана — газы. Простейший из них — метан — газ без цвета, вкуса и запаха (запах газа, почувствовав который, надо звонить $104$, определяется запахом меркаптанов — серосодержащих соединений, специально добавляемых к метану, используемому в бытовых и промышленных газовых приборах, для того, чтобы люди, находящиеся рядом с ними, могли по запаху определить утечку).
Углеводороды состава от $С_5Н_{12}$ до $С_{15}Н_{32}$ — жидкости; более тяжелые углеводороды — твердые вещества.
Температуры кипения и плавления алканов постепенно увеличиваются с возрастанием длины углеродной цепи. Все углеводороды плохо растворяются в воде, жидкие углеводороды являются распространенными органическими растворителями.
Химические свойства.
1. Реакции замещения. Наиболее характерными для алканов являются реакции свободнорадикального замещения, в ходе которого атом водорода замещается на атом галогена или какую-либо группу.
Приведем уравнения наиболее характерных реакций.
Галогенирование:
$CH_4+Cl_2→CH_3Cl+HCl$.
В случае избытка галогена хлорирование может пойти дальше, вплоть до полного замещения всех атомов водорода на хлор:
$CH_3Cl+Cl_2→HCl+{CH_2Cl_2}↙{\text"дихлорметан(хлористый метилен)"}$,
$CH_2Cl_2+Cl_2→HCl+{CHСl_3}↙{\text"трихлорметан(хлороформ)"}$,
$CHCl_3+Cl_2→HCl+{CCl_4}↙{\text"тетрахлорметан(четыреххлористый углерод)"}$.
Полученные вещества широко используются как растворители и исходные вещества в органических синтезах.
2. Дегидрирование (отщепление водорода). В ходе пропускания алканов над катализатором ($Pt, Ni, Al_2O_3, Cr_2O_3$) при высокой температуре ($400-600°С$) происходит отщепление молекулы водорода и образование алкена:
$CH_3—CН_3→СH_2=CH_2+Н_2$
3. Реакции, сопровождающиеся разрушением углеродной цепи. Все предельные углеводороды горят с образованием углекислого газа и воды. Газообразные углеводороды, смешанные с воздухом в определенных соотношениях, могут взрываться. Горение предельных углеводородов — это свободнорадикальная экзотермическая реакция, которая имеет очень большое значение при использовании алканов в качестве топлива:
$СН_4+2О_2→СО_2+2Н_2O+880 кДж.$
В общем виде реакцию горения алканов можно записать следующим образом:
$C_{n}H_{2n+2}+({3n+1}/{2})O_2→nCO_2+(n+1)H_2O$
Термическое расщепление углеводородов:
$C_{n}H_{2n+2}{→}↖{400-500°C}C_{n-k}H_{2(n-k)+2}+C_{k}H_{2k}$
Процесс протекает по свободнорадикальному механизму. Повышение температуры приводит к гомолитическому разрыву углерод-углеродной связи и образованию свободных радикалов:
$R—CH_2CH_2:CH_2—R→R—CH_2CH_2·+·CH_2—R$.
Эти радикалы взаимодействуют между собой, обмениваясь атомом водорода, с образованием молекулы алкана и молекулы алкена:
$R—CH_2CH_2·+·CH_2—R→R—CH=CH_2+CH_3—R$.
Реакции термического расщепления лежат в основе промышленного процесса — крекинга углеводородов. Этот процесс является важнейшей стадией переработки нефти.
При нагревании метана до температуры $1000°С$ начинается пиролиз метана — разложение на простые вещества:
$CH_4{→}↖{1000°C}C+2H_2$
При нагревании до температуры $1500°С$ возможно образование ацетилена:
$2CH_4{→}↖{1500°C}CH=CH+3H_2$
4. Изомеризация. При нагревании линейных углеводородов с катализатором изомеризации (хлоридом алюминия) происходит образование веществ с разветвленным углеродным скелетом:
5. Ароматизация. Алканы с шестью и более углеродными атомами в цепи в присутствии катализатора циклизируются с образованием бензола и его производных:

В чем причина того, что алканы вступают в реакции, протекающие по свободнорадикальному механизму? Все атомы углерода в молекулах алканов находятся в состоянии $sp^3$-гибридизации. Молекулы этих веществ построены при помощи ковалентных неполярных $С—С$ (углерод — углерод) связей и слабополярных $С—Н$ (углерод — водород) связей. В них нет участков с повышенной и с пониженной электронной плотностью, легко поляризуемых связей, т.е. таких связей, электронная плотность в которых может смещаться под действием внешних факторов (электростатических полей ионов). Следовательно, алканы не будут реагировать с заряженными частицами, т.к. связи в молекулах алканов не разрываются по гетеролитическому механизму.
Алкены
К непредельным относят углеводороды, содержащие в молекулах кратные связи между атомами углерода. Непредельными являются алкены, алкадиены (полиены), алкины. Непредельным характером обладают также циклические углеводороды, содержащие двойную связь в цикле (циклоалкены), а также циклоалканы с небольшим числом атомов углерода в цикле (три или четыре атома). Свойство непредельности связано со способностью этих веществ вступать в реакции присоединения, прежде всего водорода, с образованием предельных, или насыщенных, углеводородов — алканов.
Алкены — ациклические углеводороды, содержащие в молекуле, помимо одинарных связей, одну двойную связь между атомами углерода и соответствующие общей формуле $С_{n}Н_{2n}$.
Свое второе название — олефины — алкены получили по аналогии с жирными непредельными кислотами (олеиновая, линолевая), остатки которых входят в состав жидких жиров — масел (от лат. oleum — масло).
Гомологический ряд этена
Неразветвленные алкены составляют гомологический ряд этена (этилена):
$С_2Н_4$ — этен, $С_3Н_6$ — пропен, $С_4Н_8$ — бутен, $С_5Н_{10}$ — пентен, $С_6Н_{12}$ — гексен и т. д.
Изомерия и номенклатура
Для алкенов, так же, как и для алканов, характерна структурная изомерия. Структурные изомеры отличаются друг от друга строением углеродного скелета. Простейший алкен, для которого характерны структурные изомеры, — это бутен:

Особым видом структурной изомерии является изомерия положения двойной связи:
$СН_3—{СН_2}↙{бутен-1}—СН=СН_2$ $СН_3—{СН=СН}↙{бутен-2}—СН_3$
Вокруг одинарной углерод-углеродной связи возможно практически свободное вращение атомов углерода, поэтому молекулы алканов могут приобретать самую разнообразную форму. Вращение вокруг двойной связи невозможно, что приводит к появлению у алкенов еще одного вида изомерии — геометрической, или цис-транс изомерии.

Цис- изомеры отличаются от транс- изомеров пространственным расположением фрагментов молекулы (в данном случае метильных групп) относительно плоскости $π$-связи, а следовательно, и свойствами.
Алкены изомерны циклоалканам (межклассовая изомерия), например:

Номенклатура алкенов, разработанная ИЮПАК, схожа с номенклатурой алканов.
1. Выбор главной цепи.
Образование названия углеводорода начинается с определения главной цепи — самой длинной цепочки атомов углерода в молекуле. В случае алкенов главная цепь должна содержать двойную связь.
2. Нумерация атомов главной цепи.
Нумерация атомов главной цепи начинается с того конца, к которому ближе находится двойная связь. Например, правильное название соединения:

$5$-метилгексен-$2$, а не $2$-метилгексен-$4$, как можно было бы предположить.
Если по положению двойной связи нельзя определить начало нумерации атомов в цепи, то его определяет положение заместителей, так же, как для предельных углеводородов.

3. Формирование названия.
Названия алкенов формируются так же, как и названия алканов. В конце названия указывают номер атома углерода, у которого начинается двойная связь, и суффикс, обозначающий принадлежность соединения к классу алкенов, — -ен.
Например:

Физические и химические свойства алкенов
Физические свойства. Первые три представителя гомологического ряда алкенов — газы; вещества состава $С_5Н_{10}$ - $С_{16}Н_{32}$ — жидкости; высшие алкены — твердые вещества.
Температуры кипения и плавления закономерно повышаются при увеличении молекулярной массы соединений.
Химические свойства.
Реакции присоединения. Напомним, что отличительной чертой представителей непредельных углеводородов — алкенов является способность вступать в реакции присоединения. Большинство этих реакций протекает по механизму
1. Гидрирование алкенов. Алкены способны присоединять водород в присутствии катализаторов гидрирования, металлов — платины, палладия, никеля:
$CH_3—CH_2—CH=CH_2+H_2{→}↖{Pt}CH_3—CH_2—CH_2—CH_3$.
Эта реакция протекает при атмосферном и повышенном давлении и не требует высокой температуры, т.к. является экзотермической. При повышении температуры на тех же катализаторах может пойти обратная реакция — дегидрирование.
2. Галогенирование (присоединение галогенов). Взаимодействие алкена с бромной водой или раствором брома в органическом растворителе ($CCl_4$) приводит к быстрому обесцвечиванию этих растворов в результате присоединения молекулы галогена к алкену и образования дигалоген алканов:
$СН_2=СН_2+Br_2→CH_2Br—CH_2Br$.
3.
$CH_3-{CH}↙{пропен}=CH_2+HBr→CH_3-{CHBr}↙{2-бромпропен}-CH_3$
Эта реакция подчиняется правилу Марковникова:
При присоединении галогеноводорода к алкену водород присоединяется к более гидрированному атому углерода, т.е. атому, при котором находится больше атомов водорода, а галоген — к менее гидрированному.
Гидратация алкенов приводит к образованию спиртов. Например, присоединение воды к этену лежит в основе одного из промышленных способов получения этилового спирта:
${CH_2}↙{этен}=CH_2+H_2O{→}↖{t,H_3PO_4}CH_3-{CH_2OH}↙{этанол}$
Обратите внимание на то, что первичный спирт (с гидроксогруппой при первичном углероде) образуется только при гидратации этена. При гидратации пропена или других алкенов образуются вторичные спирты.

Эта реакция протекает также в соответствии с правилом Марковникова — катион водорода присоединяется к более гидрированному атому углерода, а гидроксогруппа — к менее гидрированному.
5. Полимеризация. Особым случаем присоединения является реакция полимеризации алкенов:
$nCH_2{=}↙{этен}CH_2{→}↖{УФ-свет,R}(...{-CH_2-CH_2-}↙{полиэтилен}...)_n$
Эта реакция присоединения протекает по свободнорадикальному механизму.
6. Реакция окисления.
Как и любые органические соединения, алкены горят в кислороде с образованием $СО_2$ и $Н_2О$:
$СН_2=СН_2+3О_2→2СО_2+2Н_2О$.
В общем виде:
$C_{n}H_{2n}+{3n}/{2}O_2→nCO_2+nH_2O$
В отличие от алканов, которые устойчивы к окислению в растворах, алкены легко окисляются под действием растворов перманганата калия. В нейтральных или щелочных растворах происходит окисление алкенов до диолов (двухатомных спиртов), причем гидроксильные группы присоединяются к тем атомам, между которыми до окисления существовала двойная связь:

Алкадиены (диеновые углеводороды)
Алкадиены — ациклические углеводороды, содержащие в молекуле, помимо одинарных связей, две двойные связи между атомами углерода и соответствующие общей формуле $С_{n}Н_{2n-2}$.
В зависимости от взаимного расположения двойных связей различают три вида диенов:
— алкадиены с кумулированным расположением двойных связей:
— алкадиены с сопряженными двойными связями;
$CH_2=CH—CH=CH_2$;
— алкадиены с изолированными двойными связями
$CH_2=CH—CH_2—CH=CH_2$.
Эти все три вида алкадиенов существенно отличаются друг от друга по строению и свойствам. Центральный атом углерода (атом, образующий две двойные связи) в алкадиенах с кумулированными связями находится в состоянии $sp$-гибридизации. Он образует две $σ$-связи, лежащие на одной прямой и направленные в противоположные стороны, и две $π$-связи, лежащие в перпендикулярных плоскостях. $π$-Связи образуются за счет негибридизированных р-орбиталей каждого атома углерода. Свойства алкадиенов с изолированными двойными связями весьма специфичны, т.к. сопряженные $π$-связи существенно влияют друг на друга.
р-Орбитали, образующие сопряженные $π$-связи, составляют практически единую систему (ее называют $π$-системой), т.к. р-орбитали соседних $π$-связей частично перекрываются.
Изомерия и номенклатура
Для алкадиенов характерна как структурная изомерия, так и цис-, транс-изомерия.
Структурная изомерия.
— изомерия углеродного скелета:

— изомерия положения кратных связей:
${CH_2=CH—CH=CH_2}↙{бутадиен-1,3}$ ${CH_2=C=CH—CH_3}↙{бутадиен-1,2}$
Цис-, транс- изомерия (пространственная и геометрическая)
Например:
Алкадиены изомерны соединениям классов алкинов и циклоалкенов.
При формировании названия алкадиена указывают номера двойных связей. Главная цепь должна обязательно содержать две кратные связи.
Например:

Физические и химические свойства алкадиенов
Физические свойства.
В обычных условиях пропандиен-1,2, бутадиен-1,3 — газы, 2-метилбутадиен-1,3 — летучая жидкость. Алкадиены с изолированными двойными связями (простейший из них — пентадиен-1,4) — жидкости. Высшие диены — твердые вещества.
Химические свойства.
Химические свойства алкадиенов с изолированными двойными связями мало отличаются от свойств алкенов. Алкадиены с сопряженными связями обладают некоторыми особенностями.
1. Реакции присоединения. Алкадиены способны присоединять водород, галогены, галогеноводороды.
Особенностью присоединения к алкадиенам с сопряженными связями является способность присоединять молекулы как в положениях 1 и 2, так и в положениях 1 и 4.

Соотношение продуктов зависит от условий и способа проведения соответствующих реакций.
2. Реакция полимеризации. Важнейшим свойством диенов является способность полимеризоваться под воздействием катионов или свободных радикалов. Полимеризация этих соединений является основой синтетических каучуков:
$nCH_2={CH—CH=CH_2}↙{бутадиен-1,3}→{(... —CH_2—CH=CH—CH_2— ...)_n}↙{\text"синтетический бутадиеновый каучук"}$.
Полимеризация сопряженных диенов протекает как 1,4-присоединение.
В этом случае двойная связь оказывается центральной в звене, а элементарное звено, в свою очередь, может принимать как цис- , так и транс- конфигурацию.

Алкины
Алкины — ациклические углеводороды, содержащие в молекуле, помимо одинарных связей, одну тройную связь между атомами углерода и соответствующие общей формуле $С_{n}Н_{2n-2}$.
Гомологический ряд этина
Неразветвленные алкины составляют гомологический ряд этина (ацетилена):
$С_2Н_2$ — этин, $С_3Н_4$ — пропин, $С_4Н_6$ — бутин, $С_5Н_8$ — пентин, $С_6Н_{10}$ — гексин и т. д.
Изомерия и номенклатура
Для алкинов, так же как и для алкенов, характерна структурная изомерия: изомерия углеродного скелета и изомерия положения кратной связи. Простейший алкин, для которого характерны структурные изомеры положения кратной связи класса алкинов, — это бутин:
$СН_3—{СН_2}↙{бутин-1}—С≡СН$ $СН_3—{С≡С}↙{бутин-2}—СН_3$
Изомерия углеродного скелета у алкинов возможна, начиная с пентина:

Так как тройная связь предполагает линейное строение углеродной цепи, геометрическая (цис-, транс- ) изомерия для алкинов невозможна.
Наличие тройной связи в молекулах углеводородов этого класса отражается суффиксом -ин , а ее положение в цепи — номером атома углерода.
Например:

Алкинам изомерны соединения некоторых других классов. Так, химическую формулу $С_6Н_{10}$ имеют гексин (алкин), гексадиен (алкадиен) и циклогексен (циклоалкен):

Физические и химические свойства алкинов
Физические свойства. Температуры кипения и плавления алкинов, так же, как и алкенов, закономерно повышаются при увеличении молекулярной массы соединений.
Алкины имеют специфический запах. Они лучше растворяются в воде, чем алканы и алкены.
Химические свойства.
Реакции присоединения. Алкины относятся к непредельным соединениям и вступают в реакции присоединения. В основном это реакции электрофильного присоединения.
1. Галогенирование (присоединение молекулы галогена). Алкин способен присоединить две молекулы галогена (хлора, брома):
$CH≡CH+Br_2→{CHBr=CHBr}↙{1,2-дибромэтан},$
$CHBr=CHBr+Br_2→{CHBr_2-CHBr_2}↙{1,1,2,2-тетрабромэтан}$
2. Гидрогалогенирование (присоединение галогеноводорода). Реакция присоединения галогеноводорода, протекающая по электрофильному механизму, также идет в две стадии, причем на обеих стадиях выполняется правило Марковникова:
$CH_3-C≡CH+Br→{CH_3-CBr=CH_2}↙{2-бромпропен},$
$CH_3-CBr=CH_2+HBr→{CH_3-CHBr_2-CH_3}↙{2,2-дибромпропан}$
3. Гидратация (присоединение воды). Боль шое значение для промышленного синтеза кетонов и альдегидов имеет реакция присоединения воды (гидратация), которую называют реакцией Кучерова:
4. Гидрирование алкинов. Алкины присоединяют водород в присутствии металлических катализаторов ($Pt, Pd, Ni$):
$R-C≡C-R+H_2{→}↖{Pt}R-CH=CH-R,$
$R-CH=CH-R+H_2{→}↖{Pt}R-CH_2-CH_2-R$
Так как тройная связь содержит две реакционноспособные $π$-связи, алканы присоединяют водород ступенчато:
1) тримеризация.
При пропускании этина над активированным углем образуется смесь продуктов, одним из которых является бензол:

2) димеризация.
Помимо тримеризации ацетилена, возможна его димеризация. Под действием солей одновалентной меди образуется винилацетилен:
$2HC≡CH→{HC≡C-CH=CH_2}↙{\text"бутен-1-ин-3(винилацетилен)"}$
Это вещество используется для получения хлоропрена:
$HC≡C-CH=CH_2+HCl{→}↖{CaCl}H_2C={CCl-CH}↙{хлоропрен}=CH_2$
полимеризацией которого получают хлоропреновый каучук:
$nH_2C=CCl-CH=CH_2→(...-H_2C-CCl=CH-CH_2-...)_n$
Окисление алкинов.
Этин (ацетилен) горит в кислороде с выделением очень большого количества теплоты:
$2C_2H_2+5O_2→4CO_2+2H_2O+2600кДж$ На этой реакции основано действие кислородно-ацетиленовой горелки, пламя которой имеет очень высокую температуру (более $3000°С$), что позволяет использовать ее для резки и сварки металлов.
На воздухе ацетилен горит коптящим пламенем, т.к. содержание углерода в его молекуле выше, чем в молекулах этана и этена.
Алкины, как и алкены, обесцвечивают подкисленные растворы перманганата калия; при этом происходит разрушение кратной связи.
Реакции, характеризующие основные способы получения кислородсодержащих соединений
1. Гидролиз галогеналканов. Вы уже знаете, что образование галокеналканов при взаимодействии спиртов с галогеноводородами — обратимая реакция. Поэтому понятно, что спирты могут быть получены при гидролизе галогеналканов — реакции этих соединений с водой:
$R-Cl+NaOH{→}↖{H_2O}R-OH+NaCl+H_2O$
Многоатомные спирты можно получить при гидролизе галогеналканов, содержащих более одного атома галогена в молекуле. Например:
2. Гидратация алкенов — присоединение воды по $π$-связи молекулы алкена — уже знакома вам, например:
${CH_2=CH_2}↙{этен}+H_2O{→}↖{H^{+}}{C_2H_5OH}↙{этанол}$
Гидратация пропена приводит, в соответствии с правилом Марковникова, к образованию вторичного спирта — пропанола-2:

3. Гидрирование альдегидов и кетонов. Вы уже знаете, что окисление спиртов в мягких условиях приводит к образованию альдегидов или кетонов. Очевидно, что спирты могут быть получены при гидрировании (восстановлении водородом, присоединении водорода) альдегидов и кетонов:

4. Окисление алкенов. Гликоли, как уже отмечалось, могут быть получены при окислении алкенов водным раствором перманганата калия. Например, этиленгликоль (этандиол-1,2) образуется при окислении этилена (этена):
$CH_2=CH_2+[O]+H_2O{→}↖{KMnO_4}HO-CH_2-CH_2-OH$
5. Специфические способы получения спиртов. Некоторые спирты получают характерными только для них способами. Так, метанол в промышленности получают при взаимодействии водорода с оксидом углерода (II) (угарным газом) при повышенном давлении и высокой температуре на поверхности катализатора (оксида цинка):
$CO+2H_2{→}↖{t,p,ZnO}CH_3-OH$
Необходимую для этой реакции смесь угарного газа и водорода, называемую также синтез-газом ($СО + nН_2О$), получают при пропускании паров воды над раскаленным углем:
$C+H_2O{→}↖{t}CO+H_2-Q$
6. Брожение глюкозы. Этот способ получения этилового (винного) спирта известен человеку с древнейших времен:
${C_6H_{12}O_6}↙{глюкоза}{→}↖{дрожжи}2C_2H_5OH+2CO_2$
Способы получения альдегидов и кетонов
Альдегиды и кетоны могут быть получены окислением или дегидрированием спиртов . Еще раз отметим, что при окислении или дегидрировании первичных спиртов могут быть получены альдегиды, а вторичных спиртов — кетоны:

Реакция Кучерова . Из ацетилена в результате реакции гидратации получается уксусный альдегид, из гомологов ацетилена — кетоны:

При нагревании кальциевых или бариевых солей карбоновых кислот образуются кетон и карбонат металла:

Способы получения карбоновых кислот
Карбоновые кислоты могут быть получены окислением первичных спиртов альдегидов:

Ароматические карбоновые кислоты образуются при окислении гомологов бензола:

Гидролиз различных производных карбоновых кислот также приводит к получению кислот. Так, при гидролизе сложного эфира образуются спирт и карбоновая кислота. Как уже говорилось выше, реакции этерификации и гидролиза, катализируемые кислотой, обратимы:
Гидролиз сложного эфира под действием водного раствора щелочи протекает необратимо, в этом случае из сложного эфира образуется не кислота, а ее соль.
Углеводороды, в молекулах которых атомы связаны одинарными связями и которые соответствуют общей формуле C n H 2 n
+2
.
В молекулах алканов все атомы углерода находятся в состоянии sр 3 -гибридизации. Это означает, что все четыре гибридные орбитали атома углерода одинаковы по форме, энергии и направлены в углы равносторонней треугольной пирамиды - тетраэдра. Углы между орбиталями равны 109° 28′.
Вокруг одинарной углерод-углеродной связи возможно практически свободное вращение, и молекулы алканов могут приобретать самую разнообразную форму с углами при атомах углерода, близкими к тетраэдрическому (109° 28′), например, в молекуле н -пентана.

Особо стоит напомнить о связях в молекулах алканов. Все связи в молекулах предельных углеводородов одинарные. Перекрывание происходит по оси,
соединяющей ядра атомов, т. е. это σ-связи. Связи углерод - углерод являются неполярными и плохо поляризуемыми. Длина С-С связи в алканах равна 0,154 нм (1,54 10 — 10 м). Связи С-Н несколько короче. Электронная плотность немного смещена в сторону более электроотрицательного атома углерода, т. е. связь С-Н является слабополярной.
Отсутствие в молекулах предельных углеводородов полярных связей приводит к тому, что они плохо растворяются в воде, не вступают во взаимодействие с заряженными частицами (ионами). Наиболее характерными для алканов являются реакции, протекающие с участием свободных радикалов.
Гомологический ряд метана
Гомологи - вещества, сходные по строению и свойствам и отличающиеся на одну или более групп СН 2 .

Изомерия и номенклатура
Для алканов характерна так называемая структурная изомерия. Структурные изомеры отличаются друг от друга строением углеродного скелета. Простейший алкан, для которого характерны структурные изомеры, - это бутан.
Основы номенклатуры
1. Выбор главной цепи.
Формирование названия углеводорода начинается с определения главной цепи - самой длинной цепочки атомов углерода в молекуле, которая является как бы ее основой.
2. Нумерация атомов главной цепи.
Атомам главной цепи присваивают номера. Нумерация атомов главной цепи начинается с того конца, к которому ближе стоит заместитель (структуры А, Б). Если заместители находятся на равном удалении от конца цепи, то нумерация начинается от того конца, при котором их больше (структура В). Если различные заместители находятся на равном удалении от концов цепи, то нумерация начинается с того конца, к которому ближе старший (структура Г). Старшинство углеводородных заместителей определяется по тому, в каком порядке следует в алфавите буква, с которой начинается их название: метил (-СН 3), затем этил (-СН 2 -СН 3), пропил (-СН 2 -СН 2 -СН 3) и т. д.
Обратите внимание на то, что название заместителя формируется заменой суффикса -ан на суффикс —ил
в названии соответствующего алкана.
3. Формирование названия
. В начале названия указывают цифры - номера атомов углерода, при которых находятся заместители. Если при данном атоме находятся несколько заместителей, то соответствующий номер в названии повторяется дважды через запятую (2,2-). После номера через дефис указывают количество заместителей (ди
- два, три
- три, тетра
- четыре, пента
- пять) и название заместителя (метил, этил, пропил). Затем без пробелов и дефисов - название главной цепи. Главная цепь называется как углеводород - член гомологического ряда метана (метан
СН 4 , этан
С 2 Н 6 , пропан
C 3 H 8 , С 4 Н 10, пентан
С 5 Н 12 , гексан
С 6 Н 14 , гептан
C 7 H 16, октан
C 8 H 18, нонан
С 9 Н 20, декан
С 10 Н 22).

Физические свойства алканов
Первые четыре представителя гомологического ряда метана - газы. Простейший из них - метан - газ без цвета, вкуса и запаха (запах «газа», почувствовав который, надо звонить 04, определяется запахом меркаптанов - серосодержащих соединений, специально добавляемых к метану, используемому в бытовых и промышленных газовых приборах для того, чтобы люди, находящиеся рядом с ними, могли по запаху определить утечку).
Углеводороды состава от С 4 Н 12 до С 15 Н 32 - жидкости; более тяжелые углеводороды - твердые вещества. Температуры кипения и плавления алканов постепенно увеличиваются с возрастанием длины углеродной цепи. Все углеводороды плохо растворяются в воде, жидкие углеводороды являются распространенными органическими растворителями.
Химические свойства алканов
Реакции замещения.
Наиболее характерными для алканов являются реакции свободнорадикального замещения, в ходе которого атом водорода замещается на атом галогена или какую-либо группу. Приведем уравнения характерных реакций галогенирования:
В случае избытка галогена хлорирование может пойти дальше, вплоть до полного замещения всех атомов водорода на хлор:
Полученные вещества широко используются как растворители и исходные вещества в органических синтезах.
Реакция дегидрирования
(отщепления водорода)
.
В ходе пропускания алканов над катализатором (Pt, Ni, А1 2 0 3 , Сг 2 0 3) при высокой температуре (400-600 °С) происходит отщепление молекулы водорода и образование алкена:
Реакции, сопровождающиеся разрушением углеродной цепи.
Все предельные углеводороды горят с образованием углекислого газа и воды. Газообразные углеводороды, смешанные с воздухом в определенных соотношениях, могут взрываться.
1. Горение предельных углеводородов
- это свободнорадикальная экзотермическая реакция, которая имеет очень большое значение при использовании алканов в качестве топлива:
В общем виде реакцию горения алканов можно записать следующим образом:
2. Термическое расщепление углеводородов.
Процесс протекает по свободнорадикальному механизму. Повышение температуры приводит к гомолитическому разрыву углерод-углеродной связи и образованию свободных радикалов.
Эти радикалы взаимодействуют между собой, обмениваясь атомом водорода, с образованием молекулы алкана и молекулы алкена:
Реакции термического расщепления лежат в основе промышленного процесса - крекинга углеводородов. Этот процесс является важнейшей стадией переработки нефти.
3. Пиролиз
. При нагревании метана до температуры 1000 °С начинается пиролиз метана - разложение на простые вещества:![]()
При нагревании до температуры 1500 °С возможно образование ацетилена:
4. Изомеризация
. При нагревании линейных углеводородов с катализатором изомеризации (хлоридом алюминия) происходит образование веществ с разветвленным углеродным скелетом:
5. Ароматизация
. Алканы с шестью или более углеродными атомами в цепи в присутствии катализатора циклизуются с образованием бензола и его производных:
Алканы вступают в реакции, протекающие по свободнорадикальному механизму, т. к. все атомы углерода в молекулах алканов находятся в состоянии sp 3 -гибридизации. Молекулы этих веществ построены при помощи ковалентных неполярных С-С (углерод - углерод) связей и слабополярных С-Н (углерод - водород) связей. В них нет участков с повышенной и с пониженной электронной плотностью, легко поляризуемых связей, т. е. таких связей, электронная плотность в которых может смещаться под действием внешних факторов (электростатических полей ионов). Следовательно, алканы не будут реагировать с заряженными частицами, т. к. связи в молекулах алканов не разрываются по гетеролитическому механизму.
– это предельные (или насыщенные) нециклические углеводороды, в которых все связи одинарные.
Общая формула:
C n H 2 n +2
Все атомы углерода в алканах имеют sp 3 - гибридизацию.
Первые четыре члена гомологического ряда алканов – газы, C 5 –C 17 – жидкости, начиная с C 18 – твердые вещества. Все алканы легче воды, не растворимы в воде и не смешиваются с ней.
Химические свойства.
1) Связь углерода с водородом в алканах малополярна.
2) Поэтому разрыв её в реакциях возможен только по гомолитическому механизму:
Это возможно только в жестких условиях.
3) Насыщенные (предельные) углеводороды не имеют возможности вступать в реакции присоединения. Для них свойственны реакции замещения водородных атомов и расщепления. Эти реакции протекают или при нагревании, или на свету, или с применением катализаторов.
Алканы не реагируют с концентрированными кислотами, щелочами, перманганатом калия, бромной водой.
I. Реакции замещения.
1) Галогенирование: радикальное замещение.
Хлор и бром на свету или при нагревании.
А) хлорирование: процесс быстрый, поэтому протекает неизбирательно, образуется смесь продуктов замещения:
СН 3 - СН 2 - СН 3 + Cl 2 – ( свет ) CH 3 -CH 2 -CH 2 Cl + CH 3 -CHCl-CH 3 + HCl
Б) бромирование:
CH 3 CH 3
СН 3 -СН 2 -СН -СН 3 +Br 2 –(свет) СН 3 -СН 2 -С -СН 3 + HBr
Бромирование – более медленный и избирательный процесс.
Избирательность бромирования:
третичный > вторичный > первичный атом углерода.
Механизм радикального замещения: Цепной свободнорадикальный.
Свободный радикал R ∙ – это ОЧЕНЬ АКТИВНАЯ частица, несущая на себе один неспаренный электрон и стремящаяся образовать связь с каким-либо другим атомом.
1) Инициирование цепи (запуск): молекула хлора под действием кванта света разрывается на два радикала Cl · :
2) Развитие цепи: радикал хлора отрывает от алкана атом водорода. При этом образуется промежуточная частица - алкильный радикал, который в свою очередь отрывает атом хлора от молекулы Cl 2 . При этом вновь получается радикал хлора и процесс повторяется – идёт продолжение цепи:
3) Обрыв цепи: соединение двух радикалов в молекулу.
2) Нитрование
(реакция М.И. Коновалова):
Механизм реакции – также радикальный.
Нагревание до 140°С с разбавленной (10%-ной) азотной кислотой:
CH 3 CH 3
СН 3 -СН 2 -СН-СН 3 + HNO 3 СН 3 -СН 2 -С-СН 3 + H 2 O
Избирательность нитрования: NO 2
третичный > вторичный > первичный атом углерода.
3) Крекинг - превращения алканов под действием нагревания.
а) Для алканов с длинными цепями при крекинге получается алкан и алкен. Причём при длине больше 5 атомов С получится смесь углеводородов разной длины.
CH 3 –CH 2 –CH 2 –CH 3 - 400°C CH 3 -CH 3 + CH 2 =CH 2
б) Крекинг метана происходит двумя возможными путями:
1. длительное нагревание метана: CH 4 - 1500° C C + 2H 2
2. мгновенное нагревание до 1500 градусов и сразу охлаждение:
2CH 4 - 1500° C H –C ≡ C –H + 3H 2
Ацетилен
4) Изомеризация – перестройка углеродного скелета с образованием других изомеров: при нагревании с катализатором AlCl 3 .
СН 3 -СН 2 -СН 2 -СН 3 -(100 о, AlCl 3) CH 3 -CH -CH 3
5) Окисление:
1) Горение:
CH 4 + 2O 2 ⇆
CO 2 + 2H 2 O
C 5 H 12 + 8O 2 ⇆
5CO 2 + 6H 2 O
2) Каталитическое окисление:
Метана: СН 4 +О 2 - (катализатор) смесь СН 3 ОН, НСОН и НСООН
Бутана: С 4 Н 10 + О 2 - (катализатор) 2 СН 3 СООН (уксусная кислота)
6) Дегидрирование и циклизация.
1) Короткие алканы дегидрируются в алкены или диены:
С 2 Н 6 –(кат., t ) C 2 H 4 + H 2
CH 3 -CH 2 -CH 2 -CH 3 –(кат.Cr 2 O 3 , t ) бутадиен + Н 2
2) В присутствии катализатора гексан и гептан превращаются в бензол и толуол соответственно.
СН 3 -СН 2 -СН 2 -СН 2 -СН 2 -СН 3 –(кат.Pt , t ) + 4 Н 2
Получение:
1) Реакция Вюрца: действие металлического натрия на моногалогенопроизводные углеводородов:
2CH 3 –CH 2 Br + 2Na CH 3 –CH 2 –CH 2 –CH 3 +2NaBr
Происходит удвоение углеродного скелета. Реакция подходит для получения симметричных алканов.
2) Декарбоксилирование солей карбоновых кислот (реакция Дюма): сплавление солей карбоновых кислот со щелочами.
Так получают метан при нагревании ацетата натрия с гидроксидом натрия.
CH 3 COONa + NaOH( сплавление ) CH 4 + Na 2 CO 3
3) Электролиз растворов солей карбоновых кислот (реакция Кольбе):
2CH 3 COONa + 2H 2 O –(эл.ток) 2СО 2 + Н 2 + С 2 Н 6 + 2NaOH
катод:
идёт разрядка воды: 2Н 2 О + 2е Н 2 + 2ОН -
анод:
разрядка аниона кислоты: 2СН 3 СОО - -2е 2СО 2 + СН 3 -СН 3
4) Гидролиз карбида алюминия – получение метана.
Al 4 C 3 + 12H 2 O 3CH 4 + 4Al(OH) 3
5) Гидрирование непредельных или циклических углеводородов в присутствии катализаторов (платины, палладия, никеля).
R–CH=CH–R’ + H 2 – kat R–CH 2 –CH 2 –R’
(циклопропан) + H 2 – Pd CH 3 –CH 2 –CH 3 (пропан)
6) Алканы можно получить из нефти крекингом или фракционной перегонкой.
Тест по теме «Алканы»2016
1.Молекула какого углеводорода может иметь разветвленную углеродную цепь?
1)метана СН 4 2)этана С 2 Н 6 3) пропана С 3 Н 8 4) бутана С 4 Н 10
2.Структурная формула пропана С 3 Н 8
1)СН 2 -СН 3 -СН 3 2)СН 3 -СН 2 -СН 3 3) СН 3 -СН-СН 4 4) СН 2 -СН 4 -СН 2
3. Основная часть природного газа
1)метан 2)этан 3)пропан 4)бутан
4.В молекуле метана имеется связь углерод -углерод
1)простая 2)двойная 3)тройная 4)такой связи нет
5.Фоормула гомолога метана 1) С 3 Н 6 2) С 4 Н 8 3) С 6 Н 12 4) С 5 Н 12
6.Укажите верное суждение
А. для алканов характерны реакции присоединения
Б. для алканов характерны реакции замещения
7.Изомеры отличаются
1)качественным составом 2)количественным составом 3)строением 4)на гомологическую разность
8. Изомером гептана является
1)2,3- диметилгептан 2) 2,3- диметилпентан 3) 2,3- диметилбутан 4) 2,3- диметилгексан
9.Формула нитроэтана
1) СН 3 -СН 2 - ONO 2 2) СН 3 -СН 2 - NO 2
3) СН 3 -СН 2 - N Н 2 4) СН 3 -СН 2 -СН 2 -СН 2 - NO 2
10. Какое вещество отсутствует в природном газе
1)метан 2)этан 3)пентан 4)бутан
11.Определите, в каком из перечисленных соединений степень окисления атома углерода максимальна?
1)СН 2 О 2) СН 3 ОН 3)СС l 4 4) С 2 Н 4
12.Каждый атом углерода в молекуле этана образует
1) две σ-связи и две π- связи 2)три σ-связи и одну π связь
3)четыре σ связи 4)одну σ и три связи
13.метан является основным компонентом
1)нефти 2)природного газа 3)синтез -газа 4)коксового газа
14.Укажите верное суждение
А. для алканов характерны реакции замещения
Б. этан обесцвечивает раствор перманганата калия
1)верно только А 2) верно только Б 3)оба суждения верны 4)оба суждения неверны
15.Какие продукты могут быть получены при взаимодействии бромэтана и бром пропана с металлическим натрием?
1)бутан 2)гексан
3)смесь бутана и гексана 4)смесь гексана, бутана, пентана
16.Укажите название радикала – СН 3
1)бутил 2) метан 3) этил 4)метил
17.Укажите формулу радикала этила
1) -С 2 Н 6 2б)-С 3 Н 7 3) –С 2 Н 5 4г) –С 4 Н 9
18.Длина С-С связи в молекулах алканов
1) 0,109 нм 2) 0,154 нм 3) 0,120 нм 4) 0,134 нм
19.В результате реакции дегидрирования алканов отщепляется:
1) вода 2) водород 3) углерод 4) кислород
20.Какие условия необходимы для начала реакции между метаном и хлором?
1) охлаждение 2) нагревание 3) повышение давления 4) освещение
21.По агрегатному состоянию алканы:
1) газы, жидкости 3В) жидкости, твердые вещества
2) газы, жидкости, твердые вещества 4) газы, твердые вещества
22. Молекула метана имеет форму:
1) четырехугольной пирамиды 2) тетраэдра 3) октаэдра 4) квадрата
23.Изомером 2,3 – диметилбутана является:
1) гексан 2) 2,3 – диметилциклогексан 3) циклогексан 4) 2-метилбутан
24.К реакции замещения НЕ относится
1) дегидрирование 2) бромирование 3) нитрование 4) хлорирование
25.На второй стадии хлорирования метана образуется
1) тетрахлорметан 2) трихлорметан 3) дихлорметан 4) 1,2 – дихлорэтан
26.Этан взаимодействует с каждым из пары веществ:
1) I 2 и Н 2 2 ) HBr и Н 2 O 3) Cl 2 и O 2 4) N 2 и NaOH
27.Хлорметан можно получить в результате взаимодействия
А) метана с хлороводородом В) метана с соляной кислотой
Б) метана с хлором при освещении Г) метана с раствором хлора в воде
28.В результате термического разложения метана при 1500 °С образуются
1) С 2 Н 2 и Н 2 2) СО и Н 2 3) С и Н 2 4)СО 2 и Н 2 О
29.В реакции бромирования пропана необходимым условием является:
1) освещение солнечным светом 3) присутствие катализатора
2) реакция происходит в обычных условиях 4) нагревание
30.Чем окисляются алканы во время процесса горения?
1) водородом воздуха 2) кислородом воздуха 3) перманганатом калия 4) алканы не горят
31.Реакция Вюрца – это реакция ….
А) нитрования алканов В) взаимодействия моногалогенпроизводного с Nа
Б) бромирования Г) нет такой реакции
32.Реакция, приводящая к удлинению углеродной цепи – это
1) изомеризация алканов 3) гидрирование алкенов
2) декарбоксилирование натриевых солей карбоновых кислот 4) реакция Вюрца
33.Что не образуется при дегидрировании алканов? 1) арены 2) алкины 3) алкены 4) адкадиены
34.Назовите «ближайшие гомологи» пропана.
1) С 4 Н 10 2) СН 4 3) С 6 Н 12 4) С 2 Н 6
35Алканы в лаборатории получают:
А) при крекинге нефти В) гидрированием угля
Б) реакцией Вюрца Г) реакцией Кучерова
36. Укажите формулу алкана, являющегося жидкостью при обычных условиях
1) С 4 Н 10 2) С 16 Н 34 3) С 7 Н 16 4) СН 4
37. С увеличением числа атомов углерода в молекулах углеводородов температура кипения этих углеводородов
1)не изменяется 2)уменьшается
3)увеличивается 4)сначала увеличивается, потом уменьшается
38.В ходе термического разложения метана при температуре 1000 0 С образуются
1)сажа и водород 2)угарный газ и водород
3) углекислый газ и водород 4) ацетилен и водород
39.При сплавлении ацетата калия и гидроксида калия выделяется газообразный продукт
1)водород 2)углекислый газ 3)метан 4) этан
40. Гексан не вступает в реакцию присоединения хлороводорода потому что
1)в его молекуле нет π-связей 2)гексан является углеводородом
3)молекула гексана неполярна 4)между атомами нет водородных связей
41.Продуктом взаимодействия(преобладающим) 2-бромпропана с натрием является
1)2,3-диметилбутан 2)гексан 3)циклогексан 4)пропен
43. Сколько разных веществ изображено на рисунке: 1) 7 2) 4 3) 3 4) 2
44.При риформинге метилциклогексана в результате реакций изомеризации и дегидрирования превращается в
1)этилциклопентан 2)гексен 3)бензол 4)толуол
45.Алканы вступают в реакции:а) замещения; б) присоединения; в) окисления; г)полимеризации; д) изомеризации
1)а,б,в 2)а,в,д 3)а,б,в,г,д 4) б,г,д
46. Этан взаимодействует с
1) галогенами 2)водородом 3) карбоновыми кислотами 4)галогеноводородами
47. Превращение бутана в бутен относится к реакции
1) полимеризации 2) дегидрирования 3) дегидратации 4) изомеризации
48. Структурным изомером нормального н-гексана является
1) 3-этилпентан 2) 2-метилпропан 3) 2,2-диметилпропан 4)2,2-диметилбутан
49.Взаимодействие метана с хлором является реакцией
1) соединения, экзотермической 2) замещения, эндотермической
3) соединения, эндотермической 4) замещения, экзотермической
50. Верны ли следующие суждения об углеводородах?
А. Все алканы - газообразны.
В. Метан обесцвечивает водный раствор перманганата калия.
1) верно только А 2)верно только В 3) верны оба суждения 4) оба суждения неверны
51. Бутан может быть получен по реакции Вюрца, схема которой
1)С 4 Н 8 t °"кат → 2) С 4 Н 9 С1 + КОН (спиртовой) → 3) С 2 Н 5 С1 + Nа → 4)2С 2 Н 4 t °"кат →
Тест по теме «Алканы»2016
52. Изобутан взаимодействует с
1) соляной кислотой 2)водородом 3) бромоводородом 4)азотной кислотой
53. Взаимодействие метана с хлором является реакцией
1)замещения, необратимой 3) обмена, необратимой
2)замещения, обратимой 4) обмена, обратимой
54. При нагревании смеси 2-хлорпропана и хлорэтана с металлическим натрием образуются хлорид натрия и смесь
1)2,3-диметилбутана, бутана, 2-метилбутана 2)гексана, 2-метилбутана, 1,2-дихлорэтана
3) 2,3-диметилбутана, бутана, 2-метилбутана 4)2,3-диметилбутана, 2-метилбутана, бутена
55 Какие из следующих утверждений верны?
А. При дегидроциклизации н-гептана образуется бензол.
Б. Метан не вступает в реакции присоединения.
1)верно только А 2)верно только Б 3) верны оба утверждения 4) оба утверждения неверны
56.Название алкана СН 3 -СН(СН 3 )-СН 2 -С (СН 3 ) 2 -СН 3
57. 2-хлорбутан преимущественно образуется при взаимодействии
1) бутена-1 и хлора 2) бутина-1 и хлороводорода
3) бутана и хлора 4) бутина-2 и хлороводорода
58. Метан вступает в реакцию
1)с хлороводородом 2)с водяным паром на катализаторе
3)изомеризации 4)с бромной водой
59. Шесть атомов углерода содержит
1)2-метилбутан
2)2,2-
диметилбутан 3) 2-метилпропан 4) 3-метилгексан
60. 2-Метилпентан и 2-метилгексан по отношению друг к другу являются
1)аналогами 2)радикалами 3) гомологами 4) изомерами
61. Этан может быть получен
1)дегидратацией этанола 2)электролизом раствора ацетата калия
3)гидрированием этанола 4)дегидратацией этановой кислоты
62. Изомерами являются
1)3-метилгексан и октан 2)3-этилпентан и 3-метилпентан
3)2,2-диметилпентан и 2,2-диметилгексан 4)2-метилпентан и гексан
64.Число органических веществ, которые образуются при нагревании бромметана и бромэтана с металлическим натрием, равно 1) 1 2)2 3)3 4)4
Задания повышенного уровня трудности
66.Все алканы могут реагировать с:
1) водородом 2) кислородом 3) водой
4) хлором 5) хлороводородом 6) азотной кислотой Ответ____________
67 Для метана характерны:
1) реакция гидрирования 2) тетраэдрическая форма молекулы
3) наличие π -связи в молекуле 5) реакции с галогеноводородами
4) sp 3 -гибридизация орбиталей атома углерода в молекуле
6) горение на воздухе Ответ: ________
68. Взаимодействие пропана с хлором протекает
1)по цепному радикальному механизму 2)с промежуточным образованием частицы СН 3 -СН + -СН 3
3)без катализатора 4)в водном растворе
5)с образованием пропена 6)с разрывом σ -связи в молекуле пропана Ответ____________
69 Взаимодействие пропана и брома
3)приводит к преимущественному образованию 2-бротпропана
4)приводит к преимущественному образованию 1-бромпропана
5)протекает, как правило, в темноте
6) является каталитическим процессом Ответ: _______
69.Хлорирование метана
1)последовательно приводит к образованию различных хлорзамещённых метана
2)начинается с процесса разрыва связи в молекуле метана
3)относится к радикальным реакциям
4)осуществляется в темноте
5)является типичным каталитическим процессом
6)относится к экзотермическим процессам Ответ: _________
70.Хлорирование метана
1)протекает по ионному механизму 2)относится к радикальным реакциям
3)начинается с процесса разрыва связи в молекуле хлора 5)относится к эндотермическим процессам
4)протекает через промежуточную реакцию: СН 4 →С + 4Н 6)приводит к образованию хлорметана
Ответ: __________
71.Механизм реакции хлорирования метана включает в себя следующие стадии:
1)СН 4 → СН 3 + Н 2)С1 2 → 2С1
3)С1 + СН 4 → СН 3 С1 + Н 4)СН 4 → С + 4Н
5)С1 2 + СН 4 → СН 3 С1 +НС1 6)Н + Cl → HC1
Ответ: __________
72. Взаимодействие 2-метилпропана и брома
1)относится к реакциям замещения
2)протекает по радикальному механизму
3)приводит к преимущественному образованию 1-бром-2-метилпропана
4)приводит к преимущественному образованию 2-бром-2-метилпропана
5)протекает, как правило, в темноте
6)является каталитическим процессом Ответ: __________
73. 2-Метилбутан характеризует то, что он
1)используется для получения изопрена
2)взаимодействует с хлором в присутствии А1С1 3
3)при хлорировании образует преимущественно 2-хлор-2-метилбутан
4)является изомером диметилпропана
5)при взаимодействии с гидроксидом меди (II) образует 2-метилбутаналь
6)не образует взрывоопасных смесей с воздухом
Ответ:__________
74.Этан характеризует то, что он
1)может быть получен при электролизе пропионата калия 2)взаимодействует с бромом на свету
3)при дегидрировании последовательно превращается в этилен и ацетилен
4)вступает в реакцию Вюрца 5)окисляется воздухом при н.у.
6)является гомологом октана Ответ: ______________
75.Реакция бромирования метана протекает
1)по радикальному механизму 2) в одну стадию
3) с образованием различных бромпроизводных 4)в темноте и без нагревания
5)с выделением теплоты
6)в соответствии с правилом В.В.Марковникова Ответ:______.
76. Для получения метана можно использовать реакции:
1) нагревание ацетата калия с гидроксидом калия 2) разложение этана при нагревании
3) гидролиз карбида алюминия 4) хлорметана с натрием
5) восстановления метаналя 6) водорода с углеродом Ответ: _________
77. По радикальному механизму протекает взаимодействие
1) пропена и бромной воды 2) пропена и бромоводорода
3) пропена и хлора (в водном растворе) 4) пропена и хлора (при 500°С)
5) этана и кислорода 6) метана и хлора
Ответ: ________
78. Метан образуется при
1) гидролизе карбида кальция СаС 2 2) гидролизе карбида алюминия А1 4 С 3
3) гидрировании этилена 4) прокаливании ацетата натрия с гидроксидом натрия
5) разложении бензола 6) дегидратации этилового спирта Ответ: ____________ .
79. Для бутана характерны:
1) изомеризация 4)взаимодействие в натрием
2)гидратация 5)гидрирование
3)взаимодействие с галогенами 6)каталитическое окисление
Ответ: ____________
80. Выберите признаки, характерные для этана:
А) газообразное вещество Б) горит бледным синеватым пламенем
В) имеет резкий запах Г) в 1,5 раз тяжелее водорода
Д) растворим в воде Е) вступает в реакции присоединения
Ответ: _____________________






